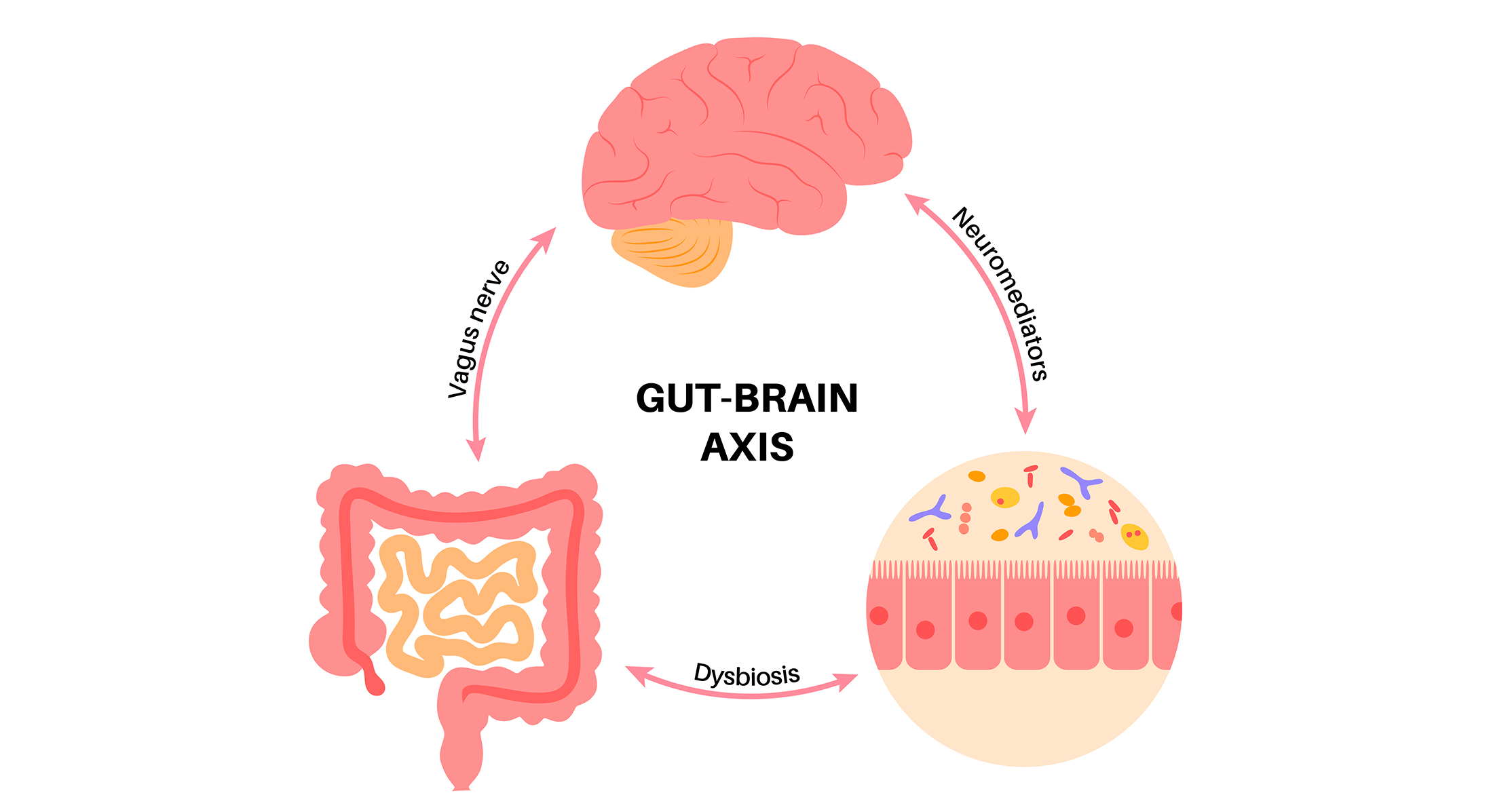
El cerebro y el intestino se comunican de tres formas diferentes
La idea de que el cerebro y el intestino se comunican se remonta a los siglos XIX y XX, y Darwin, Beaumont y Cannon ya observaron que había una conexión entre las emociones, los pensamientos y la digestión.
Aunque la investigación de la influencia de la microbiota intestinal en el cerebro (y viceversa) aún es incipiente, los científicos han descubierto las tres rutas principales que usa la microbiota intestinal para afectar al eje intestino-cerebro:
- Señales neuronales directas (similar a la comunicación con teléfonos móviles): el nervio vago y los nervios espinales de la ruta del colon son los principales canales de comunicación entre el intestino y el cerebro.
- Hormonas, neurotransmisores y mediadores neuroactivos producidos por la microbiota intestinal (similar a la comunicación por correo postal): la dieta y los microorganismos del intestino tienen un papel más importante que los genes a la hora de explicar la enorme variación observada en los metabolitos plasmáticos, que, a su vez, puede influir en la función del intestino y el cerebro.
- Células inmunitarias (similar a la comunicación de emergencias, como cuando se activa una alarma de incendios al detectar humo): la activación de la respuesta inmune se da en un subconjunto de pacientes con síndrome de intestino irritable, aunque su efecto sobre los síntomas no está claro.
Premysl Bercik, investigador de la Universidad McMaster centrado en la conexión entre el intestino y el cerebro en el contexto de trastornos de la interacción intestino-cerebro como el síndrome de intestino irritable, explica que un número cada vez mayor de pruebas muestran ahora que esta comunicación entre la microbiota y el cerebro se produce en ratones y humanos.
Muchos pacientes con síndrome de intestino irritable sufren ansiedad y depresión
Recientes estudios importantes han mostrado que los pacientes con síndrome de intestino irritable -sobre todo las mujeres– suelen sufrir ansiedad (4 de cada 10 pacientes) y depresión (3 de cada 10 pacientes), y síntomas de ansiedad. Sin embargo, lo contrario también es verdad, lo que significa que los pacientes con ansiedad y depresión tienen dos veces más riesgo de desarrollar síndrome de intestino irritable.
La estrecha asociación entre la ansiedad y la depresión y el síndrome de intestino irritable es importante porque cuanto mayor sea el número de alteraciones psicológicas, más grave será el síndrome de intestino irritable.
Esto explica que la mayoría de los pacientes con síndrome de intestino irritable no puedan tratarse solo con dieta y necesiten medios no dietéticos para mejorar su calidad de vida y reducir su estrés y sus síntomas intestinales, como terapias psicológicas (terapia cognitivo-conductual e hipnoterapia para el intestino), mindfulness e incluso yoga. Una buena salud física también es importante, y hacer ejercicio y pasar tiempo en la naturaleza han mostrado efectos psicológicos positivos que, probablemente, influyan de forma indirecta en el eje intestino-cerebro.
¿Estamos preparados para usar intervenciones relacionadas con el microbioma para mejorar la salud mental y el bienestar?
Varios estudios han mostrado que transferir microbiota de pacientes con ansiedad o depresión puede provocar un comportamiento anómalo en ratones libres de gérmenes. Esto sugiere que una microbiota intestinal alterada puede estar relacionada con trastornos de la salud mental y secuelas psicológicas que sufren los pacientes con síndrome de intestino irritable.
El término «psicobiótico», basado en el vínculo entre la microbiota intestinal y la salud mental, fue acuñado en 2013 por John Cryan y Ted Dinan, de la Universidad de Cork, para describir bacterias vivas (probióticos) que afectan a la salud mental por intermediación del microbioma intestinal.
Más recientemente, la definición de psicobiótico se ha ampliado para incluir no solo a los probióticos, sino también a los prebióticos y otros modos de influir en la microbiota intestinal en beneficio de la salud mental:
- Una dieta equilibrada rica en verduras y alimentos fermentados: las personas con una «dieta psicobiótica», es decir, rica en frutas, verduras, cereales, legumbres y alimentos fermentados, parecen mostrar un estrés más reducido. En lugar de probar primero dietas restrictivas populares que evitan las fuentes de fibra preferidas por nuestra microbiota intestinal, se recomienda la dieta mediterránea: conclusiones preliminares han mostrado que ayuda a aliviar los síntomas gastrointestinales y psicológicos.
- Algunos probióticos: estudios pequeños en humanos han mostrado los beneficios de Bifidobacterium longum NCC3001 y Saccharomyces cerevisiae I-3856 para mejorar la salud intestinal y mental en personas con síndrome de intestino irritable. En adultos sanos, longum 1714 ha mostrado posibles beneficios en la reducción del estrés.
- Ácidos grasos de cadena corta: estas moléculas obtenidas de la fermentación de la fibra realizada por los microorganismos del intestino alivia los síntomas del estrés y mejora la permeabilidad intestinal en ratones con estrés psicológico.
Referencias:
De Palma G, Collins SM, Bercik P. The microbiota-gut-brain axis in functional gastrointestinal disorders. Gut Microbes. 2014; 5(3):419-29. doi: 10.4161/gmic.29417.
Cryan JF, Dinan TG. Mind-altering microorganisms: the impact of the gut microbiota on brain and behaviour. Nat Rev Neurosci. 2012; 13(10):701-12. doi: 10.1038/nrn3346.
Chen L, Zhernakova DV, Kurilshikov A, et al. Influence of the microbiome, diet and genetics on inter-individual variation in the human plasma metabolome. Nat Med. 2022; 28(11) :2333-2343. doi: 10.1038/s41591-022-02014-8.
Bennet SMP, Palsson O, Whitehead WE, et al. Systemic cytokines are elevated in a subset of patients with irritable bowel syndrome but largely unrelated to symptom characteristics. Neurogastroenterol Motil. 2018 ; 30(10):e13378. doi: 10.1111/nmo.13378.
Zamani M, Alizadeh-Tabari S, Zamani V. Systematic review with meta-analysis: the prevalence of anxiety and depression in patients with irritable bowel syndrome. Aliment Pharmacol Ther. 2019; 50(2):132-43. doi: 10.1111/apt.15325.
Midenfjord I, Borg A, Törnblom H, et al. Cumulative effect of psychological alterations on gastrointestinal symptom severity in irritable bowel syndrome. 2021; 116(4):769-79. doi: 10.14309/ajg.0000000000001038.
Loughman A, Staudacher HM. How can I improve my gut health via non-dietary means? Lancet Gastroenterol Hepatol. 2024; 9(1):20. doi: 10.1016/S2468-1253(23)00412-0.
Sarkar A, Lehto SM, Harty S, et al. Psychobiotics and the manipulation of bacteria-gut-brain signals. Trends Neurosci. 2016; 39(11):763-781. doi: 10.1016/j.tins.2016.09.002.
Berding K, Bastiaanssen TFS, Moloney GM, et al. Feed your microbes to deal with stress: a psychobiotic diet impacts microbial stability and perceived stress in a healthy adult population. Mol Psychiatry. 2023; 28(2):601-610. doi: 10.1038/s41380-022-01817-y.
Staudacher HM, Mahoney S, Canale K, et al. Clinical trial: a Mediterranean diet is feasible and improves gastrointestinal and psychological symptoms in irritable bowel syndrome. Aliment Pharmacol Ther. 2024; 59(4):492-503. doi: 10.1111/apt.17791.
Pinto-Sanchez MI, Hall GB, Ghajar K, et al. Probiotic Bifidobacterium longum NCC3001 reduces depression scores and alters brain activity: a pilot study in patients with irritable bowel syndrome. Gastroenterology. 2017; 153(2):448-459.e8. doi: 10.1053/j.gastro.2017.05.003.
Mourey F, Decherf A, Jeanne JF, et al. Saccharomyces cerevisiae I-3856 in irritable bowel syndrome with predominant constipation. World J Gastroenterol. 2022; 28(22):2509-2522. doi: 10.3748/wjg.v28.i22.2509.
van de Wouw M, Boehme M, Lyte JM, et al. Short-chain fatty acids: microbial metabolites that alleviate stress-induced brain-gut axis alterations. J Physiol. 2018; 596(20):4923-4944. doi: 10.1113/JP276431.